Entradas con la etiqueta ‘Agua’
El agua y su influencia en los procesos geológicos
 Ya con motivo del Blog´s Action Day, comencé a referirme a un agente de primerísima importancia en los procesos geológicos, que es además un recurso irreemplazable, y más escaso de lo que nos gusta pensar: el agua.
Ya con motivo del Blog´s Action Day, comencé a referirme a un agente de primerísima importancia en los procesos geológicos, que es además un recurso irreemplazable, y más escaso de lo que nos gusta pensar: el agua.
Para ingresar a este post, les recomiendo leer el que menciono más arriba, a modo de introducción.
Por otra parte, ya que hablaremos hoy de algunas de las propiedades térmicas del agua (no todas, ya que por lo extenso del tema, lo desdoblaré en dos posts), es también recomendable releer el tema relativo a conceptos como calor, temperatura, etc, en el post correspondiente.
Como acabo de adelantar, una importante propiedad física del agua es su reacción ante los cambios de temperatura.
En este post sólo me referiré a su peculiar comportamiento de contracción- dilatación, dejando para más adelante sus cambios de estado.
¿Cómo cambia su volumen el agua al variar la temperatura?
Casi todas las sustancias, sean sólidas, líquidas o gaseosas, se contraen al enfriarse, y también lo hace el agua, salvo al acercarse a su punto de congelamiento.
Efectivamente, desde los 4° C, a medida que desciende su temperatura, el agua comienza una expansión, que se hace más rápida en el pasaje del estado líquido al sólido, a los 0° C.
Esto es fácilmente visualizable cuando una botella de vidrio con agua se deja en el congelador, y estalla, a menos que se le haya dejado espacio vacío suficiente como para absorber ese aumento de volumen.
Ahora bien, recordemos que densidad= masa sobre volumen: es decir que igual masa repartida en más volumen da menos densidad.
Ésa es la razón también por la que el hielo flota en el agua, ya que al aumentar su volumen hasta alrededor de un 9%, mientras conserva la misma masa, resulta menos denso que a estado líquido. Si así no fuera el caso, ¡¡¡cuántas lágrimas se habría visto impedido de provocar el film Titanic!!!
Otras notables consecuencias de esta manera de reaccionar ante la temperatura, implican acciones geológicas de mayor importancia.
¿Qué otros procesos geológicos se relacionan con ese comportamiento térmico del agua?
El agua que penetra en las grietas de las rocas y se congela en ellas, ejerce gran presión sobre las paredes de las mismas, llegando a provocar una forma de ruptura que se denomina crioclastismo, gelivación o gelifracción. (críos= frío; clasto= fragmento) y que forma parte del proceso de meteorización que veremos en detalle en otros posts.
¿Qué otras influencias geológicas se desprenden de los cambios de temperatura del agua?
Conviene aclarar que los rangos de temperatura a los que ahora nos estamos refiriendo son los de la atmósfera es decir, los que ocurren estacionalmente, o entre el día y la noche. No estamos hablando de intervalos como los de las termas o volcanes. No hoy por lo menos.
Aclarado ese punto, podemos decir que otro fenómeno particularmente interesante que resulta de la dilatación del agua a partir de los 4° y hasta los 0° C, se relaciona con la dinámica lacustre.
¿Cómo se modifican las condiciones de los lagos en respuesta a cambios estacionales de temperatura en zonas frías?
Como ya se dijo, por arriba, y también por debajo de los 4° C, el agua se dilata, de lo cual se deduce que alcanza su mayor densidad precisamente en ese punto.
De esta forma, cuando un lago se congela, no lo hace desde abajo hacia arriba, como cabría esperar considerando que la superficie externa es la de mayor exposición al calentamiento solar, y la difusión de calor hacia abajo disminuye con la profundidad.
Por el contrario, cuando superficialmente alcanza los 4°C, esa porción superior se hunde, por su mayor densidad, exponiendo nuevas masas de agua al enfriamiento hasta 4°.
Este ciclo se repite una y otra vez hasta que todo el lago se encuentra a esa temperatura, y sólo entonces puede seguir bajando el registro térmico, hasta el punto de congelamiento sin que la película superficial se hunda en el líquido subyacente, ya que todo nuevo descenso de temperatura en esa área superficial implicará también menor densidad.
Esto permite a muchos lagos de volumen suficiente, mantener su estado líquido aun con temperaturas ambientes muy inferiores a 0°C., ya que el propio hielo superficial (el primero en formarse) actúa como una cubierta aislante que retrasa notablemente el congelamiento profundo.
Las principales consecuencias de este proceso, se hacen notar en las comunidades vivas que tienen su hábitat en esos lagos, por un lado, y en la dinámica erosiva y sedimentaria por otro.
¿Por qué esta forma de congelamiento influye en la dinámica geológica del lago?
Porque por debajo de la costra superficial de hielo, las partículas se siguen depositando lentamente, y porque pueden ocurrir deslizamientos de sedimentos o corrientes de turbidez, de las que hablaremos más adelante.
¿Qué otros efectos tiene esta característica del agua?
Igualmente importante resulta en tales situaciones el efecto moderador de la rigurosidad del clima, -que explicaremos mejor en el próximo post sobre este tema- que el espejo no helado ejerce sobre el entorno.
Todos estos procesos quedarían interrumpidos si los lagos se congelaran desde abajo hacia arriba, ya que a veces, en temperaturas extremas, ni siquiera llegarían a descongelarse en verano.
No obstante, por lo general, dada la dinámica recientemente descripta, los congelamientos, que sólo se producen a nivel superficial, se revierten de manera relativamente rápida, con el aumento de temperatura propio del cambio de estación.
Claro que esto también hace que las superficies heladas, delgadas y frágiles de ciertos lagos sean a veces trampas peligrosas para animales y humanos que se aventuran a caminar sobre ellos sin considerar estas características.
Espero que les haya interesado el tema.
Bibliografía:
ARGÜELLO, GRACIELA L. 2002. LOS RECURSOS SUELO Y AGUA. Libro de Texto para el Trayecto Ciencias de la Tierra, del PROGRAMA DE POSTITULACIÓN EN CIENCIAS NATURALES, de la F.C.E.F. y Naturales de la U.N.Cba. Versión actualizada, corregida y aumentada. 86 págs. ISBN Nº987-9406.
Si este post les ha gustado como para llevarlo a su blog, o a la red social, por favor, mencionen la fuente porque esta página está registrada con IBSN 04-10-1952-01.
Un abrazo y hasta el miércoles. Graciela.
El agua de las brujas, su explicación científica
 ¿Qué es el agua de las brujas?
¿Qué es el agua de las brujas?
En estos días en que se aproxima la fiesta de Halloween, me pareció pertinente comentar esa creencia popular, según la cual, llevar un vaso de agua limpia al dormitorio cuando se dispone uno a dormir, es una manera de eliminar las «malas ondas» de personas malintencionadas.
Efectivamente, mucha gente pone en práctica esa costumbre, y llama al vaso de agua destinado a «absorber las malas vibraciones ajenas», el agua de las brujas.
Conozco personas educadas que esgrimen al día siguiente el vaso mostrando sus muchas burbujas, a las que interpretan como el resultado de la «acción de limpieza» de toda clase de malas influencias, ojeaduras, etc. etc., diciendo con total convicción:
-«¡Mirá, mirá qué cantidad de malas ondas me mandan! Decí que tengo el vasito éste, si no…»
Bueno, pues es hora de echar por tierra el mito, ya que con buenas o malas intenciones, con o sin gente envidiosa alrededor, el agua con la que ustedes pernocten siempre estará llena de burbujas al día siguiente, porque se trata de un proceso natural e inevitable… a menos que aprendan a reemplazar la respiración por la fotosíntesis, cosa que no veo como muy probable.
¿Qué es el aire?
Empecemos por analizar la naturaleza del aire atmosférico. Se trata de una mezcla de gases compuesta aproximadamente por 78% de nitrógeno (N), 21 % de oxÃgeno (O), y un 1% de otros gases, con amplia dominancia del dióxido de carbono CO2.
El aire en el dormitorio de cualquier cristiano tendrá más o menos esa composición, hecha la salvedad de algunas variaciones dependientes de su grado de ventilación y/o polución.
No olvidemos que en un ambiente cerrado la constitución del aire puede verse afectada por mil cosas, desde los elementos volátiles aportados por un sahumerio hasta los dudosos escapes resultantes de una opípara cena. 😀 Sin embargo, difícilmente la composición al comienzo de la noche se apartará demasiado de la ya descrita.
Ahora bien, a medida que avanzan las horas, la respiración de los bellos durmientes consumirá oxígeno, y devolverá CO², con lo cual la proporción entre ambos puede variar bastante, y la presión parcial de cada componente cambiará también.
¿Qué es la presión parcial de un gas?
Ahora voy a explicarlo en términos tan sencillos como sea posible, y espero que los colegas no me salten a la yugular por algunas simplificaciones que voy a hacer, y empiecen a los gritos con la Ley de Henry o el postulado de Dalton, que omitiré mencionar y analizar aquí, en aras de una mejor comprensión, por más que tengan relación con el tema.
Hecha esta aclaración previa, una manera muy fácil de entender el concepto de presión parcial, es asumir que en una mezcla de gases, la presión total del conjunto resulta de la suma de las presiones de los distintos compuestos presentes, cada una de las cuales es proporcional a la cantidad de ese compuesto, que forma parte de la mezcla.
Suena difícil, pero lo que significa es simplemente que cuanto mayor sea la cantidad de un gas dado, mayor será su presión parcial.
Para hacerlo más fácil todavía, veamos un ejemplo clásico.
Si la presión atmosférica es de 1 atmósfera (atmósfera es una unidad de medida de presión de gases), y la composicion del aire es la que mencionamos más arriba, la presión parcial de nitrógeno será 0,78 atmósferas (ya que hay 78% de N en la mezcla); la del oxígeno será 0,21 (porque hay 21%) y la de los demás gases 0,01 atmósfera.
¿Esas presiones parciales son constantes?
Como ya expliqué más arriba, la presión depende de la concentración de cada gas, y como ya dije también, a lo largo de la noche, el aire de un dormitorio tendrá cada vez más CO² (además de otros eventuales contaminantes) y la presión parcial de este gas aumentará.
¿Cómo se produce entonces el enriquecimiento en burbujas del agua del vaso?
Muy simple, el aumento selectivo en la presión del CO², hará que éste se disuelva en el agua del vaso, ya que todo gas se mueve desde las zonas donde su presión parcial es mayor hacia las zonas donde ésta es menor.
En este caso se mueve desde el aire hacia el agua que tiene la capacidad de admitirlo en solución, y que al comienzo no lo contiene, es decir que en el primer momento la presión parcial de CO² en el agua es igual o próxima a 0.
Las burbujas que se ven después son precisamente las provocadas por el CO² disuelto, y por esa razón, mientras respiremos, necesariamente se van a formar en el agua, haya o no haya «malas ondas» en el ambiente.
Bueno, mis queridos, ya ven que llevar el vasito a la mesa de luz es al cuete, a menos que sea para no levantarse a buscarlo si tienen sed a la noche.
Nos vemos el miércoles, y vayan preparando los disfraces para Halloween. Un abrazo. Graciela.
Si este post les ha gustado como para llevarlo a su blog, o a la red social, por favor, mencionen la fuente porque esta página está registrada con IBSN 04-10-1952-01.
Blog’s action Day: hoy el agua
Un día determinado de cada año, (esta vez el 15 de octubre) los participantes del Día de Acción de los Blogs, tenemos el compromiso de subir un post que se relacione con cualquiera de los aspectos de un tema de interés mundial, de tal manera que éste se instale simultáneamente en toda la red, llamando a todos a refelexionar sobre el mismo.
El tópico de este año es el agua, y el aspecto que un blog como éste puede abordar es precisamente el de la divulgación científica, por lo cual les presento en lugar de los acostumbrados posts de esparcimiento de los viernes, una introducción al conocimiento del agua. Y digo introducción, porque serán muchas las veces que nos referiremos a tema tan vital en numerosos posts.
¿Por qué referirnos al agua?
No es en absoluto necesario abundar acerca de la importancia que el agua tiene en todo el sistema natural. Tanto para la vida como para los procesos geológicos endógenos y exógenos, o en su carácter de recurso, es obviamente un elemento irreemplazable, pero por otra parte escaso e irregularmente distribuido, lo cual lo convierte en muchos casos en motivo de serios conflictos entre especies, comunidades, y países.
Tomar conciencia de estas situaciones es un primer paso necesario para su mejor administración y cuidado.
¿Cuáles son las principales propiedades físicas del agua?
En buena medida, el importante rol que acabamos de describir, se debe a sus propiedades, muchas de las cuales son exclusivas.
Esas propiedades físicas, si bien son harto conocidas, responden generalmente a causas relacionadas con su estructura atómica, lo cual merece especial atención, ya que de esas cualidades, a su vez, surgen las condiciones que la constituyen en un agente geológico particularmente activo.
Entre sus características más destacadas, puede decirse que en un estado puro, es incolora, inodora, insípida, tiene alto poder disolvente, y pasa por los tres estados de la materia en un rango de temperaturas relativamente estrecho, si se lo compara con la mayoría de las sustancias. Hoy nos ocuparemos de sólo una de estas propiedades, reservando para posteriores posts las restantes.
¿A qué se debe la capacidad disolvente del agua?
Como ya se señaló, el comportamiento del agua puede explicarse en función de su estructura molecular, la cual comprende dos átomos de Hidrógeno- con una carga positiva cada uno- y un átomo de Oxígeno, con dos cargas negativas.
Si bien esta estructura implica un equilibrio de cargas, su disposición espacial es tal que -por estar ambos átomos de H del mismo lado respecto al de Oxígeno- la molécula en su conjunto presenta un extremo cargado positivamente, y el otro negativamente, constituyendo un auténtico dipolo. (Figura 1)
Es por esta causa que el agua tiene capacidad para disolver muchos compuestos químicos, cuyos integrantes son atraídos por alguno de los extremos (cargados eléctricamente) de ese dipolo, con mayor fuerza que las propias uniones del compuesto, resultando «arrancados» de él, y determinando la solubilización.

FIGURA 1. (tomada de Sawkins et al 1974)
En la figura 2, los segmentos con carga positiva en un extremo, y negativa en el otro, representan a las moléculas de agua, que se adhieren a los integrantes de la sal común,- cloruro de sodio- es decir, cloro (negativo) y sodio (positivo), hasta conseguir su separación o solubilización. (Nótese que para no saturar los dibujos, en cada uno de ellos, sólo uno de los segmentos que representan las moléculas de agua tienen señalados los extremos positivo y negativo)
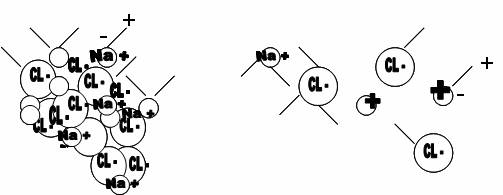
FIGURA 2. (tomada de Sawkins et al 1974)
Bibliografía:
ARGÜELLO, GRACIELA. 2002. LOS RECURSOS SUELO Y AGUA. Libro de Texto para el Trayecto Ciencias de la Tierra, del PROGRAMA DE POSTITULACIÓN EN CIENCIAS NATURALES, de la F.C.E.F. y Naturales de la U.N.Cba. Versión actualizada, c
Si este post les ha gustado como para llevarlo a su blog, o a la red social, por favor, mencionen la fuente porque esta página está registrada con IBSN 04-10-1952-01.
Un abrazo y hasta el lunes. Graciela.
orregida y aumentada.86 págs. ISBN Nº 987-9406.
SAWKINS,F.J; CHASE,C.; DARBY,D.G.; RAPP.G. Jr.1974. «The evolving earth» Mac Millan Publishing Co.
Cómo conservar el agua siempre fresca en el campo
 En estos días de terrible calor, mantener el agua fresca a lo largo de una caminata, puede ser todo un problema en el campo .
En estos días de terrible calor, mantener el agua fresca a lo largo de una caminata, puede ser todo un problema en el campo .
Me dirán ustedes que no, que para eso se inventaron las cantimploras, y las conservadoras de hielo, y yo estaré sólo en parte de acuerdo con ustedes.
Cuando se trata de una permanencia de un día, la cantimplora puede ser un fresco suministro más que suficiente, y la conservadora, bien surtida, esperando en el vehículo, para culminar la jornada, puede ser un regalo del cielo.
Pero ¿qué pasa cuando uno va a estar varios días en un campamento en el medio de la nada? No piensen en un camping de lujo con todos los chiches, incluyendo una proveeduría con bebidas frescas y con hielo para reponer en la conservadora todas las mañanas.
Piensen mejor en una carpa en el medio de la precordillera, o en un viaje de varios días atravesando parajes inhóspitos donde los bidones de agua van fuera de la conservadora, porque ella está reservada para la comida, (del primer día y gracias, porque después ¡¡¡chau hielo!!!)
Allí es donde los pequeños trucos que nos sugiere la experiencia se valorizan.
Yo, por ejemplo, he renegado de las caramañolas.
Y paso a explicarles por qué.
Son excelentes aislantes térmicos, es decir que mantienen la temperatura original del líquido, o sea que si yo la cargo de un bidón a temperatura ambiente, tomaré algo más parecido a un caldo que a una bebida refrescante.
Con ellas no puedo enfriar una bebida, sólo puedo conservarle la temperatura que ya tiene.
Entonces, la modesta y nunca bien ponderada botellita plástica de gaseosa de medio litro se convierte en mi estrella favorita.
Pueden usar envases más grandes si quieren, pero a mí esa miniatura me alcanza, y es muy cómoda para transportarla cargada al hombro durante kilómetros y kilómetros de caminata.
El primer día, salgo de mi casa con el agua congelada en la botella, (siempre tengo dos o tres botellas listas en el freezer) y a medida que transcurre la jornada, la voy consumiendo según se descongela.
Su transporte me es muy cómodo en un pequeño aparejo ad hoc que descubrí en Perú, y que ahora me acompaña a todas partes. Y que es el que ilustra este post precisamente. Un par de tiras, una faja de tela, y allá va la botellita, sin molestar a nadie, y sin quejarse ni una vez, colgando de mi hombro.
Para la siguiente recarga, al día siguiente, cuento con el bidón, pero ¿cómo refresco el agua?
Aprovecho sus propiedades térmicas, de las que hablaremos en detalle muy pronto, porque son fascinantes.
En efecto, sabemos que el agua consume una gran cantidad de energía térmica (calor, bah,) para evaporarse, y toma ese calor de todo lo que se le ponga a tiro. Por ejemplo mi botellita.
Entonces ¿qué hago? Muy simple, envuelvo la botella con el agua a consumir, en un trapo empapado, y lo dejo al aire por un par de horas.
Mientras preparo el desayuno, y lo tomo, por ejemplo, mientras ultimo los detalles del plan de la jornada y me visto para partir, etc, etc.
En ese tiempo, el agua del trapo se irá evaporando y mi bebida se enfriará notablemente.
En el portabotella, mi envase puede ir envuelto todo el tiempo en el trapo hasta que se seque del todo. Cada tanto puedo remojarlo en un arroyo, o con un poco de la misma agua de la botella, sólo como para mantener el proceso de evaporación. (No abusen que el agua es para tomar)
Hagan la prueba, y verán que funciona. Cuanto más viento corra, más intenso el proceso de evaporación y más fría el agua, o la coca, o la naranjada, o lo que tengan en el envase.
¿Les gustó el truquito? Pronto les traeré otros.
Un abrazo. Graciela.
Si este post les ha gustado como para llevarlo a su blog, o a la red social, por favor, mencionen la fuente porque esta página está registrada con IBSN 04-10-1952-01.